Флавивирусы: проникновение в клетку и ингибиторы репродукции
Исследование конформационных превращений белков оболочки флавивирусов, сопровождающих проникновение вирусов в клетку, методом молекулярной динамики. Молекулярный дизайн и систематический поиск низкомолекулярных противовирусных соединений — потенциальных средств для профилактики или лечения клещевого энцефалита, лихорадки денге и других социально значимых заболеваний
Вирусы рода Flavivirus вызывают опасные и широко распространённые инфекционные заболевания: лихорадки денге и Западного Нила, жёлтую лихорадку, клещевой энцефалит. Эти заболевания переносятся комарами или клещами и передаются человеку при укусе. Несмотря на значительные усилия мирового научного сообщества, к настоящему времени доступны средства профилактики (вакцины) лишь для клещевого энцефалита, жёлтой лихорадки и японского энцефалита. Для лечения клещевого энцефалита используются препараты иммуноглобулинов, имеющие ограниченную применимость. Средств эффективного предотвращения либо специфического лечения иных флавивирусных заболеваний, в том числе редких (омская геморрагическая лихорадка, энцефалит Повассан, энцефалит Сент-Луис и т.д.), в настоящее время не существует.
В сотрудничестве с Институтом полиомиелита и вирусных энцефалитов имени М. П. Чумакова и другими научными организациями сотрудники лаборатории ведут исследования в областях вычислительной структурной биологии, химической вирусологии, хемогеномики, дизайна и поиска новых противовирусных соединений, липидомики. Основными объектами исследований в настоящее время являются белки E оболочки вириона флавивирусов, в частности, вируса клещевого энцефалита. Эти белковые макромолекулы образуют внешнюю оболочку вирусной частицы, как выполняя функцию её изоляции от внешней среды, так и играя важную роль в процессе проникновения вируса в клетку хозяина. Конформационные изменения, происходящие в белках оболочки при понижении рН в эндосоме, приводят к образованию белковых шипов, вонзающихся в мембрану и перегруппировывающих липиды таким образом, чтобы генетический материал вируса мог проникнуть в цитоплазму и осуществить репликацию.
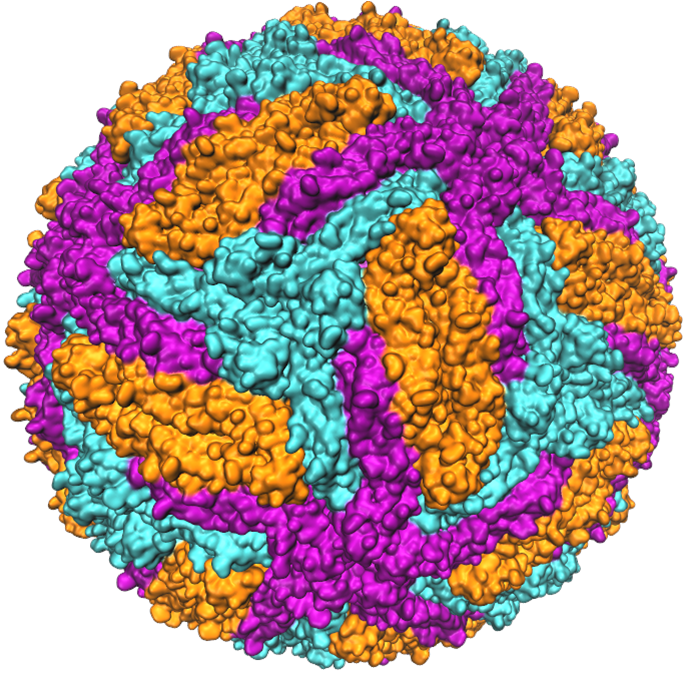
Благодаря достижениям современной структурной биологии накоплен значительный массив структурных данных о флавивирусах и белках их оболочки, однако детальное понимание механизма конформационных изменений и слияния мембран до сих пор не достигнуто. Наши исследования в этой области позволяют выявить факторы, влияющие на этот механизм и его эффективность, путём сравнения особенностей штаммов вируса клещевого энцефалита, отличающихся точечными аминокислотными заменами, а также путём поиска ингибиторов слияния и анализа спектра их противовирусной активности.
Нами было установлено, что важнейшим фактором, влияющим на способность вируса клещевого энцефалита связываться с низкоаффинными клеточными рецепторами — молекулами гликозаминогликанов — является не аминокислотная последовательность белка оболочки, а его подвижность и характер движения (Kozlovskaya et al., 2010). Точечные аминокислотные замены, индуцирующие изменение подвижности, оказывают влияние также на такие свойства вируса, как термостабильность и фенотип.
На основе результатов виртуального скрининга методом молекулярного докинга нами идентифицированы низкомолекулярные соединения, относящиеся к различным классам, с высокой противовирусной активностью в отношении вируса клещевого энцефалита, а также проявляющие активность в отношении других флавивирусов — вируса омской геморрагической лихорадки и вируса Повассан (Osolodkin et al., 2013; Sedenkova et al., 2015). В настоящее время ведётся дизайн и синтез новых соединений, которые могли бы обладать превосходящими свойствами, на основе результатов прогноза методом докинга и анализа лиганд-рецепторных взаимодействий методом молекулярной динамики (Dueva et al., 2014).
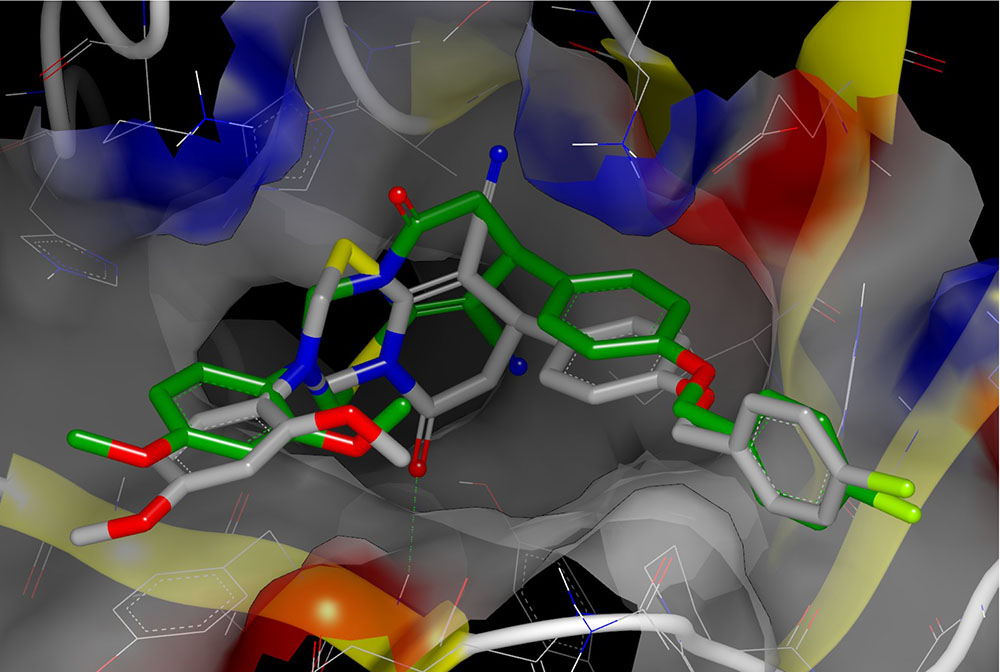
Ведутся исследования по моделированию молекулярной динамики для гетеротетрамерного фрагмента оболочки вириона, состоящего из двух субъединиц белка Е и двух субъединиц белка М. Предварительный анализ был проведён для неявно заданной мембраны (Osolodkin et al., 2012), в настоящее время накоплены и анализируются траектории длительной молекулярной динамики (500 нс) для гетеротетрамерного фрагмента оболочки вируса клещевого энцефалита. При расчётах используется суперкомпьютер "Ломоносов" (НИВЦ МГУ).
Публикации
- L. I. Kozlovskaya, A. D. Golinets, A. A. Eletskaya, A. A. Orlov, V. A. Palyulin, S. N. Kochetkov, L. A. Alexandrova, D. I. Osolodkin. Selective inhibition of Enterovirus A species members’ reproduction by furano[2,3-d]pyrimidine nucleosides revealed by antiviral activity profiling against (+)ssRNA viruses. ChemistrySelect, 2018, 3, 2321–2325.
- A. A. Orlov, M. S. Drenichev, V. E. Oslovsky, N. N. Kurochkin, P. N. Solyev, L. I. Kozlovskaya, V. A. Palyulin, G. G. Karganova, S. N. Mikhailov, D. I. Osolodkin. New tools in nucleoside toolbox of tick-borne encephalitis virus reproduction inhibitors. Bioorganic & Medicinal Chemistry Letters, 2017, 27, 1267–1273.
- A. V. Aralov, G. V. Proskurin, A. A. Orlov, L. I. Kozlovskaya, A. A. Chistov, S. V. Kutyakov, G. G. Karganova, V. A. Palyulin, D. I. Osolodkin, V. A. Korshun. Perylenyltriazoles inhibit reproduction of enveloped viruses. European Journal of Medicinal Chemistry, 2017, 138, 293–299.
- A. A. Orlov, A. A. Chistov, L. I. Kozlovskaya, A. V. Ustinov, V. A. Korshun, G. G. Karganova, D. I. Osolodkin. Rigid amphipathic nucleosides suppressing reproduction of tick-borne encephalitis virus. MedChemComm, 2016, 7, 495–499.
- K. N. Sedenkova, E. V. Dueva, E. B. Averina, Y. K. Grishin, D. I. Osolodkin, L. I. Kozlovskaya, V. A. Palyulin, E. N. Savelyev, B. S. Orlinson, I. A. Novakov, G. M. Butov, T. S. Kuznetsova, G. G. Karganova, N. S. Zefirov. Synthesis and Assessment of 4-Aminotetrahydroquinazoline Derivatives as Tick-Borne Encephalitis Virus Reproduction Inhibitors. Organic & Biomolecular Chemistry, 2015, 13, 3406–3415.
- E. V. Dueva, D. I. Osolodkin, L. I. Kozlovskaya, V. A. Palyulin, V. M. Pentkovski, N. S. Zefirov. Interaction of Flaviviruses with Reproduction Inhibitors Binding in β-OG Pocket: Insights from Molecular Dynamics Simulations. Molecular Informatics, 2014, 33, 695–708.
- D. I. Osolodkin, L. I. Kozlovskaya, E. V. Dueva, V. V. Dotsenko, Y. V. Rogova, K. A. Frolov, S. G. Krivokolysko, E. G. Romanova, A. S. Morozov, G. G. Karganova, V. A. Palyulin, V. M. Pentkovski, N. S. Zefirov. Inhibitors of Tick-Borne Flavivirus Reproduction from Structure-Based Virtual Screening. ACS Medicinal Chemistry Letters, 2013, 4, 869–874.
- D. I. Osolodkin, L. I. Kozlovskaya, V. A. Palyulin, V. M. Pentkovski, G. G. Karganova, N. S. Zefirov. A Molecular Model and Monte Carlo Simulation of Flavivirus Envelope Building Block. Biochemical and Biophysical Research Communications, 2012, 425, 207–211.
- L. I. Kozlovskaya, D. I. Osolodkin, A. S. Shevtsova, L. I. Romanova, Y. V. Rogova, T. I. Dzhivanian, V. N. Lyapustin, G. P. Pivanova, A. P. Gmyl, V. A. Palyulin, G. G. Karganova. GAG-Binding Variants of Tick-Borne Encephalitis Virus. Virology, 2010, 398, 262–272.
Финансирование
- Гранты Российского фонда фундаментальных исследований: 12-04-31317, 14-03-31566, 14-03-00469, 15-04-08365, 16-03-01057 и др.
- Грант Российского научного фонда: 16-15-10307.



